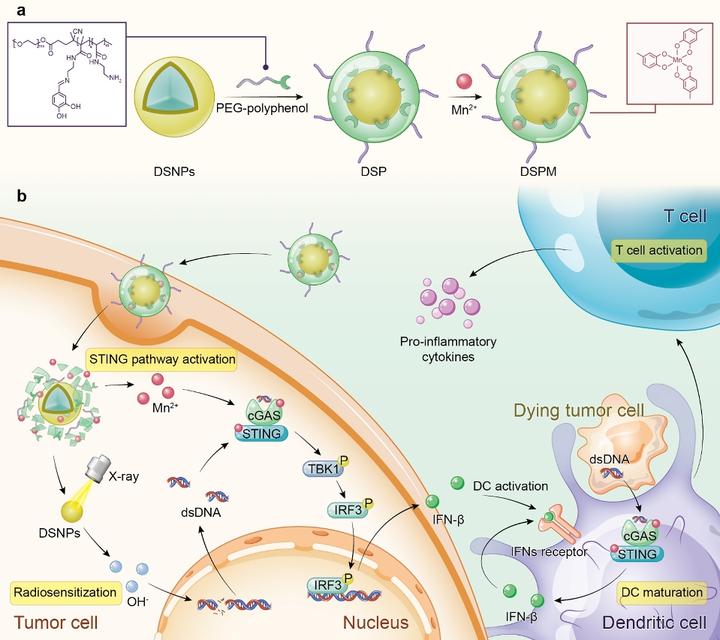
金屬—多酚網絡的構建和生物功能
澳門大學健康科學學院助理教授代雲路的研究團隊成功開發一種新型金屬多酚網絡,能有助提升腫瘤放射治療療效。團隊使用化學合成的多酚衍生物與多種金屬離子配位,構建一種新型金屬—多酚網絡DSPM,能激活腫瘤微環境STING通路,助力腫瘤放射治療。相關研究成果已在國際著名學術期刊《先進材料》(Advanced Materials)上刊登。
近年來,免疫療法的興起改變了癌症治療的模式,然而腫瘤微環境中淋巴細胞浸潤不夠,促使腫瘤變“冷”,導致免疫療法的療效不高。最新研究結果表示,干擾素基因刺激因子(stimulator of interferon genes,STING)通路的激活能啟動抗腫瘤天然免疫應答,使“冷”腫瘤轉化為“熱”腫瘤,從而提高腫瘤患者對免疫療法的療效。傳統的放射治療能誘導胞質dsDNA的形成,進而激活STING通路;此外,單獨的錳離子也可作為STING通路的激活因子,因此,團隊利用化學合成的多酚衍生物與多種金屬離子配位,構建新型金屬—多酚網絡DSPM,以激活腫瘤微環境STING通路,助力腫瘤放射治療。
研究團隊構建兩親性的PEG—多酚聚合物,能與鑭系摻雜的放療增敏劑(DSNPs)和錳離子配位形成DSPM金屬—多酚網絡。腫瘤細胞的酸性環境促使該金屬—多酚網絡解體,並釋放DSNPs和錳離子。在X-ray照射下,DSNPs敏化癌細胞促進細胞質dsDNA的生成。與此同時,釋放到胞質的錳離子激活cGAS並大大提高了其對胞質dsDNA的反應能力,激活STING通路,能促進樹突狀細胞成熟,進一步將腫瘤特異性抗原傳遞給T細胞,增強抗腫瘤免疫力。在小鼠乳腺癌模型的免疫治療結果顯示,DSPM結合X-ray照射能促使腫瘤招募更多的T淋巴細胞,釋放大量促炎細胞因子,使“冷”腫瘤轉化為“熱”腫瘤。
是次研究的通訊作者為代雲路,第一作者為澳大健康科學學院博士生顏潔、王國浩和澳大濠江博士後謝麗斯。澳大健康科學學院博士生田浩、桑瑋、李文曦、張展、博士後李傑和李蓓也對該研究做出重要貢獻。該項研究由國家自然科學基金(檔案編號:32171318和32101069)、澳門大學(檔案編號:SRG2018-00130-FHS)、國家教育部澳門大學精準腫瘤學前沿科學中心、澳門科學技術發展基金(檔案編號:0109/2018/A3、0011/2019/AKP、0113/2019/A2和0103/2021/A)和深圳-香港-澳門科技項目(檔案編號:SGDX20201103093600004)資助。研究全文可瀏覽:https:/doi.org/10.1002/adma.202105783。















